Проблема поиска новых экологически чистых материалов, используемых в качестве пропиточных средств для обработки конструкций из древесины, является актуальной. Применяемые соединения должны обладать одновременно биоцидными свойствами, быть устойчивыми к огнеразрушению, а также являться безопасными для человека. В качестве одного из вариантов решения поставленной задачи нами предлагается использовать комплексы на основе тетракоординированного бора с антимикробным действием. Предлагаемые координационные соединения содержат борную и лимонную кислоты, которые активно используются в синтезе соединений с широким спектром биоцидного и фунгицидного действия [1]. Производные дицитратобората – анионные соли, содержащие производные α-аминокислот – ранее не изучались. Наличие аминокислот гуанидина и L-α-глицина в качестве катионов внешней сферы комплексов дицитратобората глициния и дицитратобората гуанидиния соответственно определяет не только научный и практический интерес, но и позволит объяснить наличие дополнительной устойчивости к огнеразрушению изделий, обработанных представленными солями. Целью работы является сравнение физико-химических и биоцидных свойств дицитратобората глициния с его ранее полученным аналогом, дицитратоборатом гуанидиния, как антипиреновых пропиточных материалов с биоцидной активностью.
Материалы и методы исследования
Получение продукта на основе тетракоординированного бора проводили с использованием борной кислоты, L-α-глицина (аминоуксусной кислоты), безводной лимонной кислоты. Методика получения дицитратобората гуанидиния описана в [2]. Данная методика была усовершенствована авторами, что способствовало получению более высокого выхода продукта. Особенностью методики является медленное растворение борной и лимонной кислот в определенном объеме воды (примерно 40 мл) на водяной бане, поддерживающей температуру 50–60°C и с работающей магнитной мешалкой для постоянного перемешивания раствора. Соотношение исходных продуктов должно составлять в молярном соотношении 1:2:1. Кристаллизация проходила в течение двух суток, полученные кристаллы дилимоноборной кислоты повторно растворяли для перекристаллизации, их обязательно нужно промывать на первом этапе маточным раствором, затем использовать дистиллированную воду и окончательно просушить осадок этиловым эфиром. Кристаллический осадок дилимоноборной кислоты растворяли в 30 мл дистиллированной воды и к охлажденному раствору добавляли глицин. Осадок дицитратобората глициния зреет в течение 6–7 дней и представляет собой крупные белые кристаллы, растворимые в воде при интенсивном перемешивании. Кристаллы отделяли от исходного раствора фильтрованием, в воронке Бюхнера промывали спиртом и высушивали эфиром. Выход продукта составил 88,9 %.
Определение плотности дицитратобората глициния проводили по методике выполнения измерений МИ 00200851-313-2007 «Определение плотности гидростатическим методом по изооктану» на автоматическом пикнометре Accu Pic 1340 (Micrometrics) при температуре 220°С, время анализа 2–3 мин. ИК-спектр регистрировали на ИК-Фурье-спектрометре FTIR - 8400s (Shimadzu) с использованием спектрометра с преобразованием Фурье Nicolet IR200 (Thermo Scientific) c использованием приставки внутреннего отражения. Разрешение составляло 4 см-1, количество сканирований – 20.
Исследования свойств термической деструкции дицитратобората глициния дицитратобората гуанидиния проводились на синхронном термоанализаторе NETZSCH STA-449 F1Jupiter в диапазоне температур 20–950°С в среде с чистым аргоном. Проведены исследования комплексных соединений бора на биоцидную и фунгицидную активность. Для определения антимикробной активности глициницитрата бората в качестве тест-культур использовали следующие микроорганизмы: грамположительные бактерии Bacillus subtilis ATSS 6633, pumilus NCTC 8241, Bacillus mycoides 537, Micrococcus Luteus NCTC 8340, мезентероид лейкоцитов ВКПМ В-4177, золотистый стафилококк Inna 00761, золотистый стафилококк FDA 209P, микобактерия smegmatis ВКПМ Ac 1339, микобактерия smegmatis mc2 155, грамотрицательные бактерии - Escherichia coli ATS 25922, синегнойная палочка ATCC 27853, Camamonas Terrigena ВКПМ b-7571 и грибы - Aspergillus нигерийский Ina 00760, сахаромицеты – RIA 259. Антимикробную активность водных растворов бората дицитрата глицина определяли методом диффузии в агар.
Результаты исследования и их обсуждение
Для получения кристаллического осадка диглициноборной кислоты были выбраны пересыщенные растворы борной и аминоуксусной кислот, что позволило получить метастабильную систему с определенной фазой индукции кристаллизации. Цвиттер-ион глицина +H3NCH2COO− может взаимодействовать только с одной молекулой воды. Отсутствие оптической активности особенно характерно для L-α-глицина, это явление способствует полному сочетанию самой молекулы с ее зеркальным отображением при любой комбинации вращений и перемещений в трехмерном пространстве. Это свойство влияет на процесс растворения сложного соединения в воде, усиливая процесс диссоциации. Образование положительного заряда иона глицина происходит за счет акцепторных свойств аминогруппы и проявляется в кислой среде [3], поэтому в качестве промежуточного продукта целесообразно использовать дилимоноборную кислоту. Плотности ацидокомплексов бора измеряли в двух средах для получения более точного результата. Плотность дицитратобората глициния по гелию составила 1,66 г/см3, по изооктану – 1,62 г/см3. Плотность ранее синтезированного комплексного соединения дицитратобората гуанидиния по гелию составляет 1,29 г/см3, по изооктану – 1,28 г/см3.
Результаты антимикробной активности комплексных соединений в сравнении представлены в таблице.
Проведение термических исследований позволило определить момент термической деструкции молекул, при которой наблюдается максимальный выход негорючих продуктов в газовой фазе. Результаты разложения дицитратобората гуанидиния показаны на рис. 1.
Анализ кривых термической деструкции доказал достаточную термостойкость соединения до 220°С, комплекс не содержит в своем составе кристаллизационную воду. Появление эндотермического пика в диапазоне 220–252°С указывает на начало разложения лиганда, которое приводит к образованию летучего NH3 в достаточном количестве. Дальнейшее повышение температуры до 270–280°C приводит к изменению структуры внутренней сферы, в частности наблюдается процесс декарбоксилирования и разрыв С–С связей в комплексном анионе. Разрушение структуры аниона сопровождается существенной потерей массы до 43 %, результат регистрируется на дифференциальной колориметрической кривой в виде общего эндотермического минимума. После сравнения полученного результата с имеющимися данными [3] сделан вывод о полном соответствии механизма разрушения потерям по всем четырем алифатическим цепям. Последующий нагрев смеси выше 270°С необходим для полного обжига и сгорания оставшейся органической части молекулы.
Наличие экзотермических пиков при температурах 414, 567 и 851°C доказывает наличие молекул CO, CO2 и H2O.
Минимальная подавляющая концентрация комплексных соединений бора на различные культуры микроорганизмов
|
Название культуры микроорганизма |
Минимальная подавляющая концентрация, мкг/мл |
|
|
Дицитратоборат гуанидиния |
Дицитратоборат глициния |
|
|
Escherichia coli ATCC 25922 |
0,300 |
0,320 |
|
Staphylococcus aureus INA 00761 |
0,030 |
0,056 |
|
Staphylococcus aureus FDA 209P |
0,08 |
0,074 |
|
Bacillus subtilis АТСС 6633 |
– |
0,90 |
|
Bacillus pumilus NCTC 8241 |
– |
0,24 |
|
Bacillus mycoides 537 |
0,65 |
0,53 |
|
Micrococcus luteus NCTC 8340 |
0,3 |
0,26 |
|
Leuconostoc mesenteroides VKPM B-4177 |
0,04 |
0,04 |
|
Mycobacterium smegmatis VKPM Ac 1339 |
– |
2,8 |
|
Mycobacterium smegmatis mc2 155 |
0,8 |
0,85 |
|
Comamonas terrigena VKPM B-7571 |
2,4 |
2,6 |
|
Pseudomonas aeruginosa ATCC 27853 |
1,2 |
1,15 |
|
Saccharomyces cerevisiae RIA 259 |
0,003 |
0,0028 |
|
Aspergillus niger INA 00760 |
0,03 |
0,03 |
Примечание: «–» – не проявляет биоцидную активность.
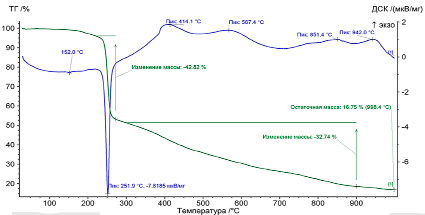
Рис. 1. Термограмма дицитратобората гуанидиния
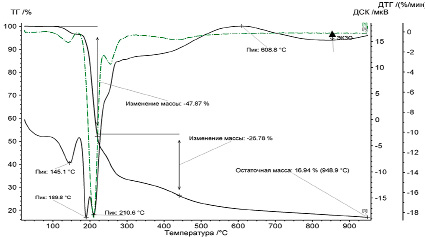
Рис. 2. Термограмма дицитратобората глициния
В газовой фазе, что способствует уменьшению массы продукта на 32 %, дополнительно выделяется еще одна доля летучих молекул NH3. Дальнейшее увеличение температуры до 942°C вызывает процесс гетерогенного окисления аммиака до N2 и оксидов азота, что доказывается наличием экзотермического пика в данной области температур. Остаточный вес после сжигания составил 16,75 %, в остатке наблюдается оксид бора B2О3.
Проведено термическое исследование аналога дицитратобората гуанидиния с целью сравнительного анализа механизма протекания деструкции. Результаты термического разложения дицитратобората глициния показаны на рис. 2.
Первое отклонение кривой от результатов экстраполяции базовой линии наблюдается при температуре 145°C, что соответствует термическому разделению кристаллизационной воды, переходящей в газообразное состояние. Данный переход определяется эндотермическим эффектом, отсутствующим при разложении дицитратобората гуанидиния.
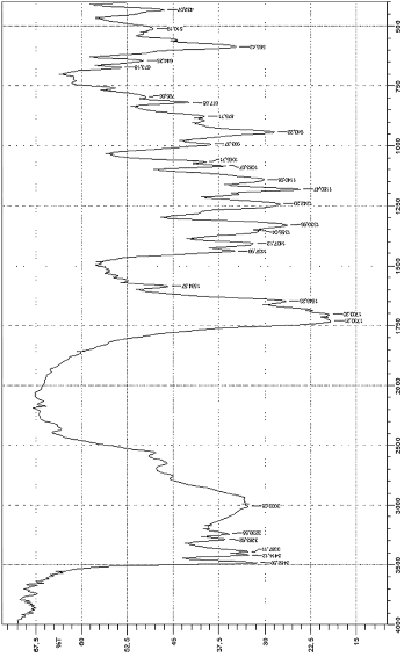
Рис. 3. Инфракрасные спектры пропускания дицитратобората гуанидиния
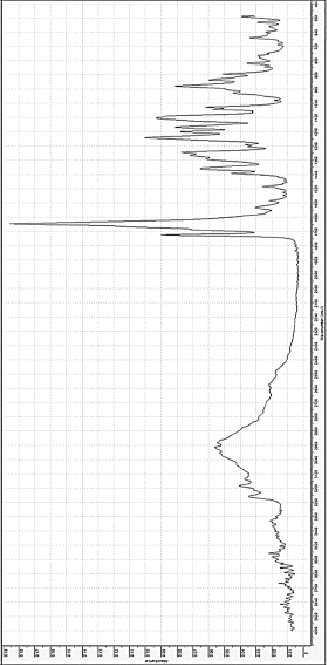
Рис. 4. ИК-спектры поглощения дицитратобората глициния
В интервале температур 170–190°С происходит расщепление концевых групп –СН2-СООН. По данным литературных источников [3, 4], термическая деструкция самого глицина должна проходить в диапазоне температур 220–310°С, при этом стадия характеризуется выраженным эндотермическим эффектом. Эндотермический эффект приводит к разрыву связей фрагмента молекулы аминокислоты. На кривой ДСК наличие пика при температуре 210°C соответствует реакции разложения глицина, дополнительным фактором является образование в большом количестве летучих молекул CO2, NH3, CO и углерода. Суммарная потеря веса за счет двух эндотермических процессов составляет 47,87 %. При температурах выше 300°C наблюдается дальнейшее разложение фрагментов комплексной соли, приводящее к общей потере массы 26,78 %. Результатом полного термического разложении дицитратобората глициния в среде аргона при диапазоне температур 170–210°С является значительно большее образование NH3, CO, CO2 по сравнению с дицитратоборатом гуанидиния за счет разложения самого глицина и разрушения комплексного аниона. Процесс разложения α-глицина при высоких температурах протекает в две стадии [5], первая стадия характеризуется выпадением вещества в осадок с образованием газообразных продуктов за счет декарбоксилирования и термической деструкции. Вторая стадия происходит при повышении температуры с 609 до 950°С и приводит к разложению аммиака на азот и оксиды азота, при этом наблюдается экзотермический максимум на кривых ДСК.
В ИК-спектре дицитратобората гуанидиния (рис. 3) полосы поглощения при 943 см-1, которые характерны для валентных флуктуаций связи B–O в тетраэдре оксида бора [2, 5].
Полоса поглощения в диапазоне 1730-1700 см-1 характеризует наличие свободных карбоксильных групп, пик при 3482 см-1 связан с флуктуациями валентности связей C=O. Наличие полос поглощения в спектре в диапазоне 1083–1065 обратных сантиметров подтверждает валентные колебания связи C–O, диапазон 3000–2500 см-1 относятся к валентным колебаниям O–H в карбоксильной группе. Полоса при 585 обратных сантиметров характеризует связь C–C, диапазон от 1460 до 1360 см–1 соответствует деформации связи C–N. Флуктуации валентности C–C–N и С=N в структурном фрагменте гуанидина CH6N3+ проявляются при 1330 и 1648 см-1. Пики при 1584 см-1, 3414–3200 см-1 доказывают наличие валентных колебаний N–H в структуре CH6N3+ и деформационных колебаний соответственно. ИК-спектр дицитратобората гуанидиния (рис. 4) имеет ряд полос, таких же, как у его аналога, дицитратобората глициния. В частности, полоса поглощения при 943 см-1 характеризует валентные флуктуации связи B–O в тетраэдре оксида бора, наличие полос 1189 см-1 и 1195 см-1 доказывает тетракоординированное состояние атома бора в комплексе. Область 1780–1720 см-1 определяет валентные колебания связи C=O, полосы поглощения 2980 см-1 и 1430–1410 см-1 соответствуют флуктуациям связи О–Н в карбоксильной группе. Сдвиг колебаний в группе C-O в сторону 1060 и 1130 см-1, наличие пика при 1320 см-1, подтверждающего деформацию и ослабление связи C-N во фрагменте глицина и объясняют возможность образования значительного количества летучих соединений при термической деструкции комплекса по сравнению с его аналогом. Пики при 1510 и 3570 см-1 вызваны ослаблением связи N-H в NH3+.
Широкие полосы поглощения в коротковолновой области объясняются присутствием кристаллизационной молекулы воды, содержащейся в катионе глицина. Дицитратоборат-анион в этих комплексных соединениях образует бидентатную координацию одного атома бора двумя молекулами лимонной кислоты с атомами кислорода центральной карбоксильной и α-гидроксильной групп. Влияние внешней сферы соединения на структуру комплексного аниона проявляется смещением полос поглощения в область более длинных волн, что способствует деформации и ослаблению связей в комплексе.
Заключение
Усовершенствована методика получения комплексного соединения на основе тетракоординированного бора, что способствует увеличению выхода продуктов. Полученные ацидокомплексы дицитратобората глициния отличаются в строении от ранее синтезированного дицитратобората гуанидиния катионами во внешней сфере. Влияние катиона глициния способствует изменению физико-химических свойств, что приводит к усилению огнезащитных характеристик. При замене катиона гуанидиния катионом глицинием наблюдается появление деформационных колебаний внутри комплекса, что приводит к ослаблению химических связей во внутренней сфере молекулы. Смещение пиков в ИК-спектрах дицитратобората глициния в область более глубоких колебаний является дополнительным доказательством ослабления связей внутри комплекса. Данный факт объясняет значительное увеличение образования негорючих газообразных продуктов при воздействии температур на данный комплекс по сравнению с его аналогом, дицитратоборатом гуанидиния. Изменение природы термической деструкции молекулы в диапазоне температур 145–210°С приводит к ряду эндотермических эффектов, которые усиливают огнезащитные характеристики соединения. Наличие антимикробной активности у комплексных соединений является дополнительным фактором, позволяющим использовать их в качестве биоцидной и фунгицидной пропитки изделий из древесины. Два важных компонента одновременно – образование больших количеств летучих продуктов (CO2, NH3, CO) при низких температурах и биоцидная активность в отношении широкого спектра микроорганизмов предполагают использование дицитратобората глициния в качестве пропиточного материала, обладающего биоцидными и огнезащитными свойствами. Сравнительная характеристика двух комплексов тетракоординированного бора показала, что дицитратоборат глициния более эффективен, чем его аналог, дицитратоборат гуанидиния.



