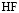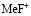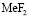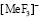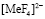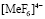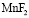Фосфорнокислый катионит КФП-12 относится к комплексообразующим, обладающий большим сродством к поливалентным и тяжелым ионам металлов. Наличие в структуре катионита фосфорнокислых ионогенных групп делает возможным сорбцию катионов металлов, как за счет реакции катионного обмена, так и за счет реализации координационной связи. Изучение сорбции ионов металлов катионитом вследствие комплексообразования позволит выявить специфические закономерности кинетики селективной сорбции, а также разработать научное обоснование критерий управления указанным процессом и практической реализации конкретных задач. В процессе сорбции ионов переходных металлов комплексообразующими ионитами в фазе последних образуются малодиссоциирующие соединения. Это приводит к изменению некоторых кинетических закономерностей, характерных для чистого ионного обмена.
В данной работе приводятся результаты исследования процесса сорбции ионов марганца фосфорнокислым катионитом КФП-12 с применением микрокалориметрического метода.
Материал и методы исследования
Исследования проводили с использованием фосфорнокислого катионита КФП-12 в 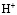 -,
-,  - формах с крупностью зерен в воздушно-сухом состоянии 0,25-0,50 мм. Термохимические опыты проводили с применением дифференциального микрокалориметра МИД-200. Калориметрический метод является информативным для определения природы и изучения закономерностей явлений, проходящих в гетерогенных системах. Методика проведения эксперимента состояла в следующем. В калориметрический стакан помещали 50 мл раствора фторида марганца. Концентрация соли менялась с целью получения различных степеней заполнения катионита ионами марганца. Проба воздушно-сухого катионита в
- формах с крупностью зерен в воздушно-сухом состоянии 0,25-0,50 мм. Термохимические опыты проводили с применением дифференциального микрокалориметра МИД-200. Калориметрический метод является информативным для определения природы и изучения закономерностей явлений, проходящих в гетерогенных системах. Методика проведения эксперимента состояла в следующем. В калориметрический стакан помещали 50 мл раствора фторида марганца. Концентрация соли менялась с целью получения различных степеней заполнения катионита ионами марганца. Проба воздушно-сухого катионита в  - форме в количестве 0,2 г и заливали 2 мл воды, выдерживали 24 часа при комнатной температуре. Этим обеспечивалось набухание образца. Полиэтиленовый стаканчик с образцом помещали в калориметрический стакан, который устанавливали в измерительную ячейку микрокалориметра. Вторая ячейка калориметра заполнялась аналогично первой, но вместо раствора соли брали воду. Измерительный блок калориметра термостатировался при 25 °С. После выхода показаний измерительных приборов на базовую линию катионит приводили в контакт с раствором вращением ядра калориметра. Результаты опыта автоматически регистрировались на компьютер. По окончанию калориметрического опыта ионит отфильтровывали и раствор анализировали для определения степени обмена.
- форме в количестве 0,2 г и заливали 2 мл воды, выдерживали 24 часа при комнатной температуре. Этим обеспечивалось набухание образца. Полиэтиленовый стаканчик с образцом помещали в калориметрический стакан, который устанавливали в измерительную ячейку микрокалориметра. Вторая ячейка калориметра заполнялась аналогично первой, но вместо раствора соли брали воду. Измерительный блок калориметра термостатировался при 25 °С. После выхода показаний измерительных приборов на базовую линию катионит приводили в контакт с раствором вращением ядра калориметра. Результаты опыта автоматически регистрировались на компьютер. По окончанию калориметрического опыта ионит отфильтровывали и раствор анализировали для определения степени обмена.
По данным калориметрических измерений определили долю тепловыделения η для различных периодов сорбции τ, которая пропорциональна степени сорбции ионов марганца F.
Результаты исследования и их обсуждение
На рис. 1 представлены экспериментальные термокинетические кривые процесса сорбции ионов марганца из водных растворов с различной исходной концентрацией. Из данных следует, что сорбция ионов марганца из растворов с концентрациями 0,002М и 0,005М катионитом в H+- форме является экзотермическим процессом, максимальная интенсивность тепловыделения наблюдается в течение 2 ч 30 мин. (для концентрации 0,002М) после чего она резко падает, приближаясь к нулю. Для концентрации марганца 0,005М максимальная интенсивность тепловыделения наблюдается при t = 1 ч, после чего наблюдается медленный спад в течение 2 ч 30 мин., а начиная с 3 ч 40 мин. резкое падение тепловыделения. С увеличением концентрации ионов марганца в растворе сорбция ионов является эндотермическим процессом. При увеличении концентрации с 0,017М до 0,049М интенсивность тепловыделения увеличивается. Максимальная интенсивность тепловыделения наблюдается для всех исследованных концентраций в течение 45 мин., после чего она уменьшается. Если рассматривать сорбцию ионов марганца на катионите в аммонийной форме (рис. 2), то процесс является эндотермическим. При минимальной концентрации 0,002М интенсивность тепловыделения увеличивается в течение 3 ч., а затем не изменяется. С увеличением концентрации начиная с 0,009М раствора тепловыделение увеличивается в течение 30 мин, а затем резко уменьшается.
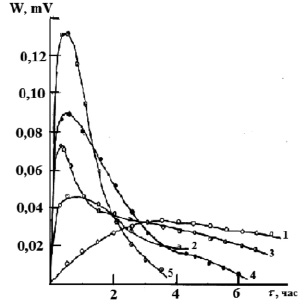
Рис. 1. Зависимость интенсивности тепловыделения от времени при сорбции ионов марганца катионитом КФП-12 в H+- форме.Концентрация ионов марганца, моль/дм3: 0,002 (1), 0,005 (2)
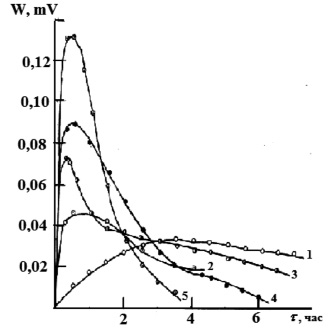
Рис. 2. Зависимость интенсивности тепловыделения от времени при сорбции ионов марганца катионитом КФП-12 в NH+4 – форме.Концентрация ионов марганца, моль/дм3: 0,002 (1), 0,009 (2), 0,017 (3), 0,027 (4), 0,032 (5)
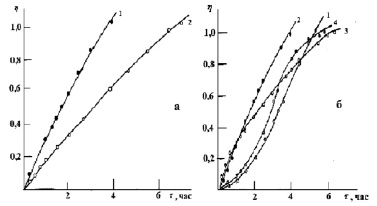
Рис. 3. Зависимость доли тепловыделения от времени ионов марганца катионитом КФП-12 в H+-(а) и NH+4- (б) формах. Концентрация ионов марганца, моль/дм3: 0,002 (1), 0,008 (2), 0,017 (3), 0,027 (4), 0,032 (5)
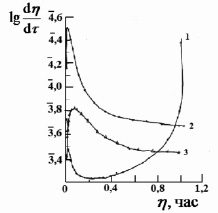
Рис. 4. Зависимость логарифма относительной скорости тепловыделения от его доли при сорбции ионов марганца катионитом КФП-12 в H+- форме.Концентрация ионов марганца, моль/дм3: 1,0 (1), 0,02 (2), 0,1 (3)
Доля тепловыделения (h) для исследованных ионов марганца приведены на рис. 3. С увеличением концентрации ионов металла в растворе изменяется и ход кривой зависимости доли тепловыделения от времени. Так, за 60 мин процесс сорбции на H+- форме катионита для ионов марганца с концентрацией 0,002 моль/дм3 протекает на 25 %, а для концентрации 0,049 моль/дм3 на 32 %. Полное превращение достигается за 240 и 335 мин. соответственно. Для аммонийной формы катионита процесс сорбции ионов протекает на 5 % (для С=0,002М) и на 8 % (для С=0,049М) за то же самое время. Полное превращение достигается за 440 и 245 мин. соответственно. Из графиков зависимости 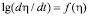 следует, что для ионов марганца при малых концентрациях характер зависимости линейный (рис. 4). С увеличением же концентрации характер зависимости изменяется, на кривых имеются точки перегиба. Такое поведение хода кривых хорошо согласуется с литературными данными [1], чем меньше скорость диффузии ионов марганца в грануле, тем меньше скорость теплопоглощения, а время сорбции больше.
следует, что для ионов марганца при малых концентрациях характер зависимости линейный (рис. 4). С увеличением же концентрации характер зависимости изменяется, на кривых имеются точки перегиба. Такое поведение хода кривых хорошо согласуется с литературными данными [1], чем меньше скорость диффузии ионов марганца в грануле, тем меньше скорость теплопоглощения, а время сорбции больше.
На основании данных калориметрических измерений был определен тип кинетики сорбции. Эти данные подтверждают гелевый тип кинетики. Обработка результатов исследования проводились с использованием уравнения [2]:
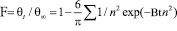
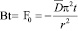 ,
,
где Bt – безразмерный параметр хомохронности; θt и θ∞ – соответственно степень насыщения ионита через t секунд и бесконечно большое время; F – степень обмена или степень достижения равновесия; D – коэффициент диффузии (взаимодиффузии), см2/с; r – радиус зерна ионита, мм; t – время, с; n – ряд целых чисел 1,2,3,4,5...... .
В соответствии с этим уравнением линейная зависимость Bt от t служит доказательством того, что скоростьопределяющей стадией процесса ионного обмена является диффузия внутри зерна ионита. На рис. 5. приведены кинетические кривые сорбции и зависимость 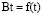 . Для всех исследованных систем наблюдается линейная зависимость. Это дает основание считать, что скорость процесса определяется диффузией в гель. Рассчитанные коэффициенты диффузии приведены в табл. 1.
. Для всех исследованных систем наблюдается линейная зависимость. Это дает основание считать, что скорость процесса определяется диффузией в гель. Рассчитанные коэффициенты диффузии приведены в табл. 1.
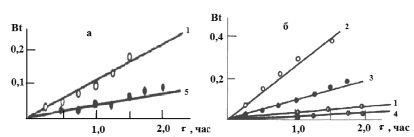
Рис. 5. Зависимость Bt от t при сорбции ионов марганца катионитом КФП-12 в H+- (а) и NH4+-(б) формах. Концентрация ионов марганца, моль/дм3: 0,002 (1), 0,008 (2), 0,017 (3), 0,027 (4), 0,032 (5)
Таблица 1
Значения коэффициентов диффузии процесса сорбции ионов из растворов 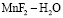 катионитом КФП-12
катионитом КФП-12
|
Система |
С, ммоль/см3 |
|
|
Н+ – форма |
||
|
|
0,002 |
0,2 |
|
0,027 |
0,9 |
|
|
|
||
|
|
0,002 |
0,8 |
|
0,008 |
1,6 |
|
|
0,017 |
6,1 |
|
|
0,027 |
9,4 |
|
Как видно из табл. 1, значения коэффициентов диффузии увеличиваются с ростом концентрации ионов в растворе. Это может быть объяснено уменьшением вклада химической реакции образования комплексных соединений.
Калориметрические исследования дают возможность рассчитать и тепловой эффект (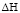 ) при сорбции ионов катионитом. Значения теплового эффекта приведены в табл. 2.
) при сорбции ионов катионитом. Значения теплового эффекта приведены в табл. 2.
Таблица 2
Изменение теплового эффекта реакции от степени заполнения двухзарядными катионами катионита КФП-12
|
Система |
С, моль/дм3 |
Степень заполнения |
Измеренное количество тепла |
кДж/моль |
|
H+- форма |
||||
|
|
0,002 |
0,017 |
-1476,330 |
-287,00 |
|
0,005 |
0,050 |
-98,911 |
-3,46 |
|
|
0,017 |
0,067 |
+449,913 |
+18,89 |
|
|
0,027 |
0,1 |
+754,164 |
+14,62 |
|
|
0,032 |
0,069 |
+1460,114 |
+33,63 |
|
|
0,049 |
0,3 |
+1015,733 |
+9,64 |
|
|
|
||||
|
|
0,005 |
0,100 |
+164,459 |
0,100 |
|
0,009 |
0,137 |
+772,062 |
0,137 |
|
|
0,017 |
0,150 |
+726,700 |
0,150 |
|
|
0,027 |
0,367 |
+272,930 |
0,367 |
|
|
0,032 |
0,300 |
+2293,925 |
0,300 |
|
Из результатов видно, что тепловой эффект сорбции из фторидных растворов зависит от степени заполнения катионита. Причем меняется не только величина, но и знак теплового эффекта. Такое влияние природы ионов можно объяснить тем, что в результате ионного обмена:
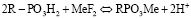
выделяется катион водорода, который может связываться с ионом фтора
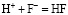 .
.
Чтобы оценить энергию образования вторичных продуктов произвели термодинамический расчет предполагаемых веществ [3], табл. 3. В данном случае это могут быть не только молекулы фтористоводородной кислоты, а также различные по составу комплексные ионы фторидов металлов.
Таблица 3
Энергия образования вторичных продуктов в процессе сорбции ионов двухзарядных металлов
|
Система |
|
|||||
|
|
|
|
|
|
|
|
|
|
19,3 |
14,17 |
-28,34 |
42,51 |
56,68 |
85,02 |
Из данных табл. 3. видно, что образование нейтральных молекул фторидов металлов и фтористоводородной кислоты идут с выделением тепла, а образование комплексных ионов с поглощением тепла. Таким образом, можно предположить, что в начальный момент сорбции изученных ионов из фторидных растворов катионитом КФП-12 на общий энергетический эффект процесса существенное влияние может оказать возможное образование фтористоводородной кислоты. Сравнивая данные калориметрических измерений при различных степенях заполнения катионита с учетом поправки на возможное образование фтористоводородной кислоты, можно сделать вывод, что это влияние будет возрастать с увеличением степени заполнения ионита и может привести даже к смене знака суммарного теплового эффекта.
Как показывают результаты табл. 2 для водородной формы катионита изменение степени заполнения приводит к изменению знака значения теплового эффекта.
При малых концентрациях ионов переходных металлов происходит реализация координационной связи (экзотермический процесс), сорбируемые ионы взаимодействуют с двумя фиксированными группами по схеме:
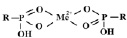
С увеличением концентрации ионов в растворе увеличиваются энергетические затраты системы, связанные с образованием структур
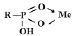
определенной стереохимии (эндотермический процесс).
Таким образом, микрокалориметрические исследование процесса сорбции ионов марганца катионитом КФП-12 дает большую информацию для определения механизма сорбции, изучения влияния различных факторов на кинетику процесса и состояния равновесия.




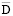 .108, см2/с
.108, см2/с
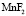
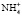 – форма
– форма
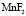
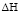 ,
,
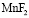
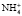 - форма
- форма
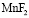
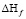 , кДж/ моль
, кДж/ моль