Совершенствование существующих методов производства минеральных удобрений имеет большое народнохозяйственное значение. Поиски условий и средств интенсификации переработки природных фосфатов, более полного использования фосфатного сырья, снижения себестоимости удобрений требуют дальнейшего изучения физико-химических свойств фосфорно-кислотных систем, скорости и механизма взаимодействия природных фосфатов с кислотами.
Исследования скорости и механизма разложения природных фосфатов в незагустевающих пульпах [1-3] позволили предложить ряд новых, так называемых циклических способов производства минеральных удобрений, в которых предусматривается разложение фосфатного сырья большим избытком фосфорной кислоты. Важное преимущество этих методов заключается в возможности применения их для переработки низкокачественного и некондиционного фосфатного сырья на высококонцентрированные фосфорные удобрения.
Одним из таких видов сырья являются чилисайские фосфориты, играющие сметную роль среди отечественных низкосортных фосфатных руд.
Для создания новых технологий переработки чилисайских фосфоритов на высококонцентрированные фосфорные удобрения необходимы данные о кинетике их разложения большим избытком фосфорной кислоты, которые в литературе отсутствуют.
Цель работы. Выяснение кинетических закономерностей разложения чилисайских фосфоритов фосфорной кислотой, взятой в большом избытке по сравнению со стехиометрией протекающих реакций с интервале 75–95 °С.
Экспериментальная часть. В экспериментах в качестве исходного сырья использовали образец чилисайской муки следующего состава, %: Р205 17,72; Si02 (нерастворимый остаток) 37,5; СаО 30,3; MgO<0,3; CО2 3,56; Fe2О3 l,26; Al2O3 1,29; F2,38. Причем 68,9 % от общего содержания Р2О5 находится в усвояемой форме. Для разложения использовали фосфорную кислоту концентрации 40,6 % Р2О5, взятую с нормой 500 % от стехиометрически необходимого количества на образование монокальций фосфата.
Опыты проводили на лабораторной установке, состоящей из стеклянного реактора емкостью 300мл с отверстиями на крышке для загрузки материалов и замера температуры раствора по мере протекания процесса, с центральной горловиной, в которой установлен обратный холодильник с мешалкой.
Термостатированный реактор заполняли определенным количеством фосфорной кислоты и включали мешалку. По достижении заданной температуры в него загружали рассчитанное количество фосфорита. Разложение проводили при 348, 353, 368° К в течение 1-45 мин. По истечении определенного промежутка времени реакцию останавливали путем добавления в пульпу слабого раствора NaOH для охлаждения и нейтрализации избыточного количества фосфорной кислоты. Затем пульпу фильтровали, осадок промывали, сушили и определяли в нем остаточное содержание Р2О5 по известным медикам.
Коэффициент разложения определяли по формуле
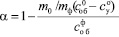 ,
,
где mо – масса осадка, г; mф – исходная масса фосфорита, г; содержание Р2О5, %: общего в осадке 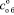 ; усвояемого в осадке
; усвояемого в осадке 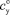 ; общего в исходном сырье
; общего в исходном сырье 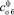
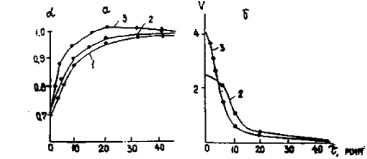
Зависимость степени (а) и скорости (б) разложения чилисайского фосфорита от времени при различных температурах, норма Н3Р04 – 500 % Т 0С- 1 – 75 2 – 80-3-95
Результаты опытов по определению скорости разложения чилисайских фосфоритов представлены на рисунке и в таблице.
Из данных рисунка, а видно, что с повышением температуры процесса степень разложения увеличивается и при 368 К достигается практически полное разложение фосфорита (и=0,9958), при 353 и 348 К коэффициент разложения за это же время составляет соответственна 0 9729 и 0,9633.
Увеличение продолжительности процесса также повышает степень разложения фосфорита, в особенности впервые 10–15 мин, дальнейшее же увеличение времени процесса не приводит к существенному повышению степени разложения.
Экспериментальные данные, приведенные на рисунке, а, позволили определить порядок реакции, рассчитать константу скорости и кажущуюся энергию активации реакции разложения чилисайских фосфоритов большим избытком фосфорной кислоты.
Скорость реакции (V) определяли как тангенс угла наклона прямых к оси абсцисс. Для определения порядка реакции применили общепринятый метод [5] аналитического решения уравнения (2). Порядок реакции при 353 К равен 1,2; при 368 К – 1,1.
Кривые изменения скорости реакции от времени при 80 и 95 °С приведены на рисунке, б. Скорость реакции уменьшается с течением времени. Лимитирующей стадией разложения является, по-видимому, диффузия фосфорной кислоты через слой продуктов реакции. В начале обработки, когда поверхность фосфорита свободна, скорость реакции максимальна, затем по мере нарастания толщины слоя продуктов реакции диффузия жидкого реагента через этот слой затрудняется, скорость процесса падает и постепенно приближается к постоянному значению.
Кинетика разложения чилисайского фосфорита фосфорной кислотой концентрации 40,6 % Р2О5 и норме 500 %
|
t, мин |
Степень разложения, c |
V |
IgV |
1–a |
Ig(l-a) |
К, мин-1 |
|
80 °С (353 К) |
||||||
|
5 |
0,7957 |
2,25 |
0,352 |
0,2043 |
-0,689 |
15,13 |
|
7 |
0,8350 |
2,057 |
0,313 |
0,165 |
-0,783 |
17,87 |
|
10 |
0,8927 |
1,15 |
0,061 |
0,1073 |
-0,969 |
16,75 |
|
12 |
0,9153 |
0,78 |
-0,109 |
0,085 |
-1,072 |
15,05 |
|
15 |
0,9320 |
0,59 |
-0.229 |
0,068 |
-1.168 |
14,86 |
|
20 |
0,9544 |
0,35 |
-0,456 |
0,046 |
-1,341 |
14,23 |
|
Среднее 15,65 95 °C (368 К) |
||||||
|
5 |
0,8734 |
2,13 |
0,327 |
0,127 |
-0,898 |
20,65 |
|
7 |
0,9021 |
1,59 |
0,201 |
0,098 |
-1,009 |
20,49 |
|
10 |
0,9467 |
0,74 |
-0,128 |
0,053 |
-1,273 |
18,75 |
|
12 |
0,9560 |
0,598 |
-0.223 |
0,044 |
-1,356 |
18,57 |
|
15 |
0,9709 |
0,436 |
-0,36 |
0,029 |
-1,536 |
21,36 |
|
20 |
0,9834 |
0,225 |
-0,648 |
0,017 |
-1,781 |
20,41 |
|
Среднее 20,04 |
||||||
Результаты расчета кинетических параметров процесса представлены в таблице. Среднее значение констант скорости для 80 и 95 °С составило соответственно 15,65 и 20,04 мин-1. Кажущуюся энергию активации определили из зависимости изменения константы скорости от температуры. Она составляет 18,24 кДж/моль, что также подтверждает диффузионный характер процесса.
Таким образом, была изучена кинетика разложения чилисайских фосфоритов большим избытком фосфорной кислоты при 348-368 К, Определены кинетические параметры разложения: порядок реакции, константы скорости реакции, кажущаяся энергия активации. Показано, что разложение чилисайского фосфорита происходит довольно быстро (за 25-30 мин). Это можно объяснить тем, что фосфатная составляющая этих фосфоритов представлена в виде не столь прочного как кальцийфторапатит минерала – курскита.
Чилисайское месторождение является второй по значению фосфатной сырьевой базой Казахстана после фосфоритов бассейна Каратау [6]. До недавнего времени единственный путь использования этого сырья – производство малоэффективной фосфоритной муки, содержащей 7-8 % Р2О5 и значительное количество (до 50 %) примесей, в основном SiO2. В настоящее время из-за нерешенности вопросов эффективного обогащения руды выпуск чилисаиской фосмуки прекращен. В связи же с необходимостью обеспечения западных регионов Казахстана фосфорными удобрениями вопрос изыскания новых рациональных способов переработки фосфоритов Чилисая приобретает особую актуальность, например, циркуляционный способ переработки низкокачественного и некондиционного фосфатного сырья на двойной суперфосфат (ДС).
Сущность метода заключается в разложении фосфорита при 348-373 К большим избытком оборотной концентрированной фосфорной кислоты, отделении нерастворимых примесей при температуре не ниже 348° К, охлаждении раствора и кристаллизации монокальцийфосфата (МКФ), отделении кристаллов МКФ, которые после нейтрализации, грануляции и сушки выдают в качестве готового продукта. Из маточного раствора, содержащего фосфорную кислоту и МКФ, путем взаимодействия с серной кислотой получают гипс и фосфорную кислоту, последнюю возвращают на растворение фосфатного сырья. Наиболее важные преимущества этого метода – практически полное разложение сырья (99-100 %) и возможность получения высококонцентрированного фосфорного удобрения из некондиционного фосфатного сырья без его предварительного обогащения.
В лабораторных условиях проведены исследования по отработке оптимальных параметров циклического метода получения ДС из чилисайских фосфоритов. Использовали образец мытой чплисайской фосфоритной муки следующего состава, мас. % : Р2О5 – 17,72; СаО – 30,3; МgО – 0,3; Fe2O3 – 1,29; А12O3 – 1,23; СO2 – 3,56; нерастворимый остаток – 37,5.
Для осуществления процесса разложения чилисайского фосфорита необходимо было подобрать такие условия, при которых образовался бы близкий к насыщению или насыщенный раствор МКФ в фосфорной кислоте, а при его охлаждении состав системы не попадал бы в поле кристаллизации дикальцийфосфата. Расчеты проводили по диаграмме растворимости системы СаО – Р2О5 – Н2О [7]. Искомая концентрация фосфорной кислоты для разложения в интервале 348 – 3730 К составила 39- 11 % Р2О5. минимальная норма кислоты – 420 % от стехиометрически обходимого для образования МКФ по реакции
Са3(Р04)2+4Н3РО4 = 3Са(Н2РО4)2. (1)
Влияние примесей не учитывали ввиду большого избытка фосфорной кислоты. Для определения условий, позволяющих полностью регенерировать фосфорную кислоту и возвратить ее на разложение, таким образом, замкнув цикл, необходимо было изучить влияние нормы фосфорной кислоты на выход МКФ при одном и том же времени разложения, температуре и времени кристаллизации МКФ. Ранее нами была изучена кинетика разложения чилисайских фосфоритов большими избытками (норма 450 –550 %) фосфорной кислоты концентрации 40 % P2O5 при 348-368 К [8].
Опыты проводили следующим образом: навеску фосфорита обрабатывали разными количествами фосфорной кислоты, причем перед опытами фосфорит декарбонизировали частью фосфорной кислоты, необходимой для разложения [9]. Разложение фосфорита проводили при 363 –368 К в течение 40 мин. Затем на обогреваемом вакуум-фильтре отделяли нерастворимый остаток, охлаждали фильтрат до 35-40 °С и отмечали время начала кристаллизации МКФ. Через определенное время отделяли на вакуум-фильтре кристаллы МКФ. взвешивали, анализировали на содержание Р2О5 по известной методике [4]. В ходе экспериментов установлено, что при соблюдении указанных условий процесса кристаллизация МКФ начинается через 15 – 20 мин после охлаждения раствора до 40 °С и практически заканчивается через 60 – 90 мин в зависимости от количества кислоты.
Результаты опытов показали, что в интервале 440 –500 % фосфорной кислоты выпадает значительное количество МКФ, превышающее необходимое для вывода из цикла по разработанной технологии. В пределах 520 -570 % фосфорной кислоты можно выделить количество МКФ, соответствующее или близкое по Р2О5 количеству вводимого сырья. Эксперименты показали, что при 520-560 % Н3РО4 увеличение продолжительности кристаллизации МКФ более 90 мни повышает количество выпадающих кристаллов. При норме фосфорной кислоты 570 % за 90 мин кристаллизация МКФ практически заканчивается, 580-600 % – скорость кристаллизации и выход МКФ резко снижаются, что связано с уменьшением пересыщения раствора по монокальцийфосфату.
Таким образом, при разложении чилисайских фосфоритов для получения ДС циклическим методом оптимальными условиями следует счищать 570 % Н3РО4 от стехиометрически необходимого по реакции (I), температуру – 363 –368° К, τ – 40 мин, время кристаллизации МКФ при 313° К – 90 мин. При соблюдении этого режима количество Р2О5, выводимое с осадком МКФ, приблизительно равно Р2О5, вводимому с фосфоритам.
Завершающей стадией циклического способа получения ДС является сульфатизация маточного раствора после отделения кристаллов МКФ серной кислотой с получением гипса и фосфорной кислоты, возвращаемой после отделения сульфата кальция на стадию разложения фосфорита. Количественные данные о скорости кристаллизации сульфата кальция из концентрированных растворов МКФ в фосфорной кислоте после обработки серной кислотой в литературе практически отсутствуют. В целях уменьшения количества вводимой в оборотную фосфорную кислоту воды сульфатизацию раствора проводили серной кислотой концентрации 92 – 93 %. Количество ее необходимое для разложения МКФ, содержащегося в растворе, рассчитывали по реакции:
5Са (H2PО4)2 + 5H2SO4+2H2O = CaSO4 · 2H2O + 10H3РO4 (2)
Предварительными опытами выявлено, что при применении концентрированной серной кислоты температура процесса резко повышается до 353 – 368 К за счет тепла реакции, что приводит к образованию мелких труднофильтруемых кристаллов. Учитывая это обстоятельство, процесс сульфатизации раствора МКФ вели в термостатированных условиях при температуре, не превышающей 323 – 333 К. Через определенные промежутки времени после введения серной кислоты пипеткой, снабженной фильтром, отбирали пробы раствора и анализировали их на содержание 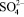 по известной методике [4]. По остаточному содержанию ионов сульфата кальция в жидкой фазе судили о скорости протекания реакции взаимодействия МКФ с серной кислотой. Процесс считали законченным, когда количество
по известной методике [4]. По остаточному содержанию ионов сульфата кальция в жидкой фазе судили о скорости протекания реакции взаимодействия МКФ с серной кислотой. Процесс считали законченным, когда количество 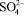 в жидкой фазе становилось постоянным. Результаты опытов по определению скорости сульфатизации раствора МКФ в фосфорной кислоте, представленные ниже, показывают, что реакция разложения МКФ протекает очень быстро и практически заканчивается за 15–20 мин (Т = 323 – 333 К, СH2SO4 – 92,8 %):
в жидкой фазе становилось постоянным. Результаты опытов по определению скорости сульфатизации раствора МКФ в фосфорной кислоте, представленные ниже, показывают, что реакция разложения МКФ протекает очень быстро и практически заканчивается за 15–20 мин (Т = 323 – 333 К, СH2SO4 – 92,8 %):
τ, мин 5 10 12 15 18 20
Содержание 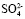 в жидкой фазе, % 5,75 3,15 0,70 0,36 0,35 0,35
в жидкой фазе, % 5,75 3,15 0,70 0,36 0,35 0,35
В целях отработки технологического режима в лабораторных условиях было проведено 7 циклов получения ДС из чилисайского мытого концентрата вышеуказанного состава. Навеску фосфорита декарбонизировали фосфорной кислотой, затем разлагали при 90-95 °С в течение 40 мин. В первом цикле для разложения использовали термическую фосфорную кислоту концентрации 40,6 % Р2O5. Затем пульпу расфильтровывание при 353-368 °С. Осадок промывали водой, сушили, взвешивали и анализировали на P2O5. Фильтрат после отделения нерастворимого остатка охлаждали до 40 °С и выдерживали при медленном перемешивании 90 мин. Образовавшиеся кристаллы МКФ отфильтровали, осадок взвешивали и анализировали на Р205, Н3Р04 и Са(Н2Р04)2. Затем нейтрализовали известняком концентрации 96 % СаС03, сушили при 373-378 К и анализировали на содержание всех форм Р2O5, а также F, MgO, A12O3, Fe2O3 по известным методикам [4]. Фильтрат взвешивали, анализировали на содержание Са(Н2РО4)2 и Н3РО4, затем обрабатывали Н2SО4 концентрации 92-93 % при температуре, не превышающей 60 °С, к течение 20 мин. Осадок отфильтровывали, промывали горячей (343-353 К) водой, сушили, анализировали на P2O5, Fe2О3, Al2O5, F. Фильтрат, полученный после отделения сульфата кальция (оборотная фосфорная кислота), взвешивали, анализировали на содержание H3PО4·H2SО4, Са(Н2РO4)2 MgO, Fe203, Аl2O3, F и возвращали на стадию разложения фосфорита.
Результаты исследования. Результаты опытов показали, что после 4 цикла устанавливается режим, позволяющий полностью регенерировать фосфорную кислоту (при смешении оборотной фосфорной кислоты с промывными водами, полученными после трехкратной промывки нерастворимое остатка и сульфата кальция) и возвращать ее на стадию разложения. ДС после нейтрализации и сушки содержит, мас. %: Р2О5 обш – 50,4 –51,0; P2О5общ 48,7–49,1; Р2О5водн 46,5 – 47,0; Р2О5св 0,65 –0,72. Нерастворимый остаток и гипс содержат 0,3 –0,5 % Р2О5водн. Результаты анализов оборотной фосфорной кислоты, представленные в таблице, показывают, что в ней не происходит значительного повышения содержания А12О3, Fe2О3, MgO, F с увеличением количества циклов. Эти пределы не оказывают заметного влияния на технологический режим. Стабилизация состава и вязкости оборотной кислоты после 4 цикла объясняется тем, что соединения железа и алюминия, приходящие с фосфоритом, выводятся из цикла с нерастворимым остатком, монокальцийфосфатом и гипсом.
Состав оборотной фосфорной кислоты, %
|
№ цикла |
Н3РО4 |
Са(Н2Р04)2 |
Р2О5 общ |
H2SО4 |
А12О3 |
Fe2О3 |
MgO |
F |
Вязкость Н3РО4, сПз |
|
1 |
65,30 |
0,31 |
47,94 |
Отс. |
Отс. |
0,34 |
Отс. |
0,9 |
2,77 |
|
2 |
68,25 |
0,09 |
49,43 |
Отс. |
Следы |
0,41 |
Отс. |
0,12 |
2,85 |
|
3 |
61,25 |
Отс. |
44,40 |
0,14 |
0,04 |
0,38 |
Следы |
0,13 |
2,98 |
|
4 |
62,71 |
Отс. |
45,44 |
0,13 |
0,03 |
0,30 |
Следы |
0,15 |
3,10 |
|
5 |
61,42 |
0,13 |
44,55 |
Отс. |
0,06 |
0,31 |
Следы |
0,21 |
3,30 |
|
6 |
60,78 |
Отс. |
44,10 |
0,09 |
0,07 |
0,35 |
Следы |
0,23 |
3,31 |
|
7 |
63,20 |
Отс. |
45,80 |
0,17 |
0,06 |
0,37 |
Следы |
0,19 |
3,30 |
Проведенные исследования показали возможность использования разработанного циклического способа для получения двойного суперфосфата из чилисайских фосфоритов.



